| |
| |
|
|
| |
|
|
| |
|
|
| |
 Methanol
Methanol |
|
| |
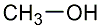
Methanol
ist so zu sagen der kleine Bruder vom Ethanol. Letzteres wird im
allgemeinen Sprachgebrauch als Alkohol bezeichnet, chemisch gesehen
gehören jedoch beide Verbindungen zur Familie der Alkohole.
Methanol ist eine farblose brennfähige Flüssigkeit. Es
schädigt nach Verschlucken Nieren, Leber sowie das Herz und
vor allem die Sehnerven, was nachfolgend zur Erblindung führen
kann. Nachlässig gebrannte Schnäpse können einen
beachtlichen Anteil an Methanol enthalten.
In der Natur kommt diese Verbindung beispielsweise in der frischen
Baumwollpflanze und einigen Gräsern vor. Zudem konnte man das
Molekül im interstellaren Raum nachweisen. In der Industrie
ist Methanol ein wichtiger Ausgangs- und Hilfsstoff bei der Herstellung
von vielen Verbindungen, Lacken oder Firnissen. Es verbrennt praktisch
ohne Rußbildung zu Wasser und Kohlenstoffdioxid, weshalb es
vereinzelt als Kraftstoff dient oder Benzin beigemengt wird. Ein
Augenmerk aktueller Forschung liegt auf der Entwicklung von Brennstoffzellen,
mit deren Hilfe die chemische Energie dieser Verbindung direkt in
elektrischen Strom umgewandelt wird. Generell ist dieses Verfahren
(vgl. auch Beitrag zum Wasserstoff) effizienter, als die Energiegewinnung
über Verbrennungsmotoren. Leider steckt diese Technologie noch
in den Kinderschuhen, so dass bislang nur die ersten Testaggregate
für tragbare Computer auf den Markt kommen. Die Herstellung
von reinem Methanol, zu der vielfach Erdgas und Erdölprodukte
- also nicht nachwachsende Rohstoffe - herangezogen werden, ist
zudem recht energieaufwändig und mit weiterer Emissionen von
Kohlendioxid verbunden.
Deike
Banser
Mehr
Informationen zum Methanol finden Sie unter:
http://dc2.uni-bielefeld.de/dc2/auto/alkohol.htm
http://dc2.uni-bielefeld.de/dc2/facharbeit/methanol.html
http://www.seilnacht.tuttlingen.com/Lexikon/alkohole.html
http://dc2.uni-bielefeld.de/dc2/facharbeit/alkohol1.html
|
|
| |
|
|
| |
 Ethanol
Ethanol |
|
| |
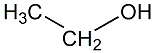
Die
allgemein nur als "Alkohol" bekannte Verbindung hat eine bewegte
Geschichte. Die Menschen beobachteten früh, dass überall, wo in
der Natur stärke- oder zuckerhaltige Produkte verfaulen, Ethanol
entsteht, so dass bereits eine etwa 8000 Jahre alte sumerische Keilinschrift
erste Tipps zur Bierbereitung gibt. Die Kelterei und das Brennen
von Hochprozentigem sind ein wenig jünger.
Doch was passiert bei der Einnahme dieser würzig riechenden und
brennbaren Flüssigkeit? Ethanol ist ein starkes Gift, das Eiweiße
im Körper angreift. Es regt an, während es bei stärkerem Genuss
schnell berauschend wirkt, ein Wärmegefühl (bei gleichzeitiger Auskühlung),
Enthemmung, Selbstüberschätzung, Sprachstörungen u.a. sind die Folgen.
Wird noch der Gang unsicher, verwundern die Beschränkungen, die
im Straßenverkehr mit dem Umgang der Einstiegsdroge Alkohol einhergehen,
nicht.
Der "Kater" am nächsten Morgen geht im übrigen selten auf Vergiftungserscheinungen
zurück; vielmehr werden dem Körper zu viele seiner Nährstoffe und
Salze bei der Verarbeitung großer Mengen Alkohol entzogen. Das übliche
"Katerfrühstück" ist daher oft sehr salzig oder scharf.
Die weltweite Produktion von alkoholischen Getränken aus Agrargütern
übertrifft fünf Millionen Tonnen pro Jahr. Daneben dient Ethanol
als Lösungsmittel, Desinfektionsmittel, als Brennspiritus und wird
industriell in der Synthese organischer Moleküle eingesetzt.
Stephan T. Hatscher
Links zur Chemikalie Ethanol:
http://www.seilnacht.tuttlingen.com/Chemie/ch_ethol.htm
http://www.zum.de/Faecher/Ch/SN/C9/Alkohole/Text.htm
Links zum Thema Alkohol als Genussmittel:
http://www.bier.de/
http://www.wein.de/index.html
Speziell zum Thema Alkoholmissbrauch:
http://www.meine-gesundheit.de/krank/texte/alkoholm.htm
http://www.netdoktor.de/ratschlaege/fakten/alkohol.htm
http://www.alkohol-hilfe.de/
|
|
| |
|
|
| |
 Aceton
Aceton |
|
| |
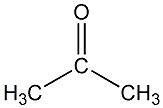
Aceton
oder 2-Propanon ist eines der gebräuchlichsten industriellen Reinigungs-
und Lösungsmittel. Es ist eine klare, brennbare Flüssigkeit, die
aromatisch riecht und leicht verdampft. Ihre guten Reinigungseigenschaften
gehen darauf zurück, dass es in beliebiger Menge mit Wasser, Alkoholen
und auch Fetten mischbar ist.
Der Stoff findet sich auch als Abfallprodukt des Stoffwechsels im
menschlichen Harn wieder – bei Diabetes ist seine Menge erhöht
und kann darin nachgewiesen werden. Ist man längere Zeit Aceton
oder seinen Dämpfen ausgesetzt, so treten Übelkeit, Kopfschmerz
bis hin zur Ohnmacht auf – auf der Haut kann es zur Bildung
von Entzündungen kommen.
Erstmals gefunden wurde das 2-Propanon von Libavius Anfang des 17.
Jahrhunderts – durch Erhitzen einer Verbindung aus Essig und
Blei. Nebenbei angemerkt: Aceton findet sich nicht nur in der chemischen
Großindustrie. Abbeiz- oder Reinigungsmittel aus dem Baumarkt enthalten
diesen Stoff ebenso wie der handelsübliche Nagellackentferner –
und auch in diesen Fällen geht die Verwendung auf die hervorragenden
Lösungseigenschaften des Acetons zurück.
Stephan T. Hatscher
Links zum Thema Aceton:
http://www.seilnacht.tuttlingen.com/Chemie/ch_aceto.htm
http://enius.de/schadstoffe/aceton.html
http://www.kremer-pigmente.de/70700.htm
|
|
| |
|
|
| |
 Schwefelsäure
Schwefelsäure |
|
| |
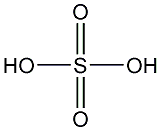
Schwefelsäure
ist eine der wichtigsten Verbindungen der chemischen Industrie,
da sie in einer Vielzahl von großtechnischen Verfahren zum
Einsatz kommt. Riesige Mengen werden beispielsweise in der Düngemittelherstellung,
bei der Produktion von Weißpigmenten für Kosmetika und
Malerfarben, bei der Herstellung zahlreicher Substanzen, wie Weichmachern
oder Tensiden, bei der Glasfabrikation oder Erdölraffination
verwendet. Nicht zuletzt ist die Schwefelsäure eine wichtige
Chemikalie in Laboratorien.
Die farblose Substanz wurde schon 1746 in einem von Roebuck und
Garbett entwickelten Verfahren erstmals industriell hergestellt.
Heute kommt sie in Wasser gelöst in verschiedenen Konzentrationen
in den Handel. Als besonders reine 32 %ige Lösung findet man
sie als so genannte Akkumulatorsäure in jeder Autobatterie.
Nach Vulkanausbrüchen ist der folgende Regen meist sauer, da
die Gase, die bei dem Ausbruch frei werden, häufig Schwefelverbindungen
enthalten, die in Wasser zu Schwefelsäure und anderen schwefelhaltigen
Säuren reagieren können.
Deike
Banser
Mehr
über Schwefelsäure können Sie hier in Erfahrung bringen:
http://www.seilnacht.tuttlingen.com/Chemie/ch_h2so4.htm
http://www.norddeutsche-affinerie.de/NA/rohstoffe/roh_schwefel
http://www.chemieunterricht.de/dc2/vermisch/vitriol.htm
|
|
| |
|
|
| |
 Alizarin
Alizarin |
|
| |
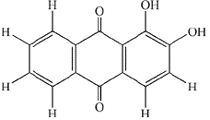
Die
gelbe Wurzel der Krapppflanze, die beim Trocknen eine rote Farbe
annimmt, wurde schon in alten Hochkulturen und der Antike zum Einfärben
von Seide, Teppichen oder Wolle verwandt. Im 16. Jahrhundert hielt
die Kultivierung der Pflanze für Färbereizwecke auch in
Mitteleuropa Einzug. Das Verfahren, nach dem bei der Färbung
mit Krappwurzel vorgegangen wurde, gehört zu der so genannten
Türkischrotfärberei.
Eine der Substanzen der Krappwurzel, die für die färbende
Eigenschaft verantwortlich ist, ist das Alizarin. Alizarin selbst
besteht aus orangegelben, nadelförmigen Kristallen. Licht-,
seifen- und säureechte Färbungen ergeben sich daraus erst
in Verbindung mit bestimmten Metallsalzen. Daher gehört das
Alizarin zu den Beizenfarbstoffen. Das zu färbende Material
wird mit der Metallbeize behandelt, bevor die eigentliche Alizarinfärbung
durchgeführt wird. Nur so bildet sich der gut haftende Farblack
auf der Faser.
Die Farbtönung wird von der Art der Metallbeize mitbestimmt,
so ergeben sich braunrote Farbtöne mit einer Chrombeize, violette
bei Verwendung einer Eisenbeize oder leuchtend rote bei Vorbehandlung
mit Aluminiumsalzlösungen. Der auch Krapplack genannte Farbstoff
diente auch zur Herstellung von lichtechten Tapeten, Druck- oder
Künstlerfarben. Heute finden die Färbungen mit Krapp oder
reinem Alizarin industriell kaum noch Anwendung.
Deike
Banser
Mehr
zum Farbstoff Alizarin erfahren Sie unter:
http://www.tu-harburg.de/b/hapke/farbstof.html
http://www.swisseduc.ch/chemie/pigmente/pigmente/einzelnepigmente/alizarin.html
http://www.seilnacht.tuttlingen.com/Lexikon/Krapp.htm
|
|
| |
|
|
| |
 Indigo
Indigo |
|
| |
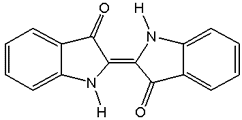
Hinter
der gefährlich anmutenden Bezeichnung 2,2'-Biindolinyliden-3,3'-dion
verbirgt sich einer der ältesten Färbestoffe der Welt, das Indigo.
Die ältesten Funde sind Malereien in steinzeitlichen Höhlen oder
gefärbter Grabschmuck ägyptischer Mumien. Cäsar beschreibt im "De
bello gallico", seine Gegner würden sich mit "Waid" blaue Kriegsbemalung
anlegen. Die Gewinnung aus dem Färberwaid, einer mitteleuropäischen
Blütenpflanze, wird erstmals im 4. Jahrhundert nach Christus dokumentiert.
Im Mittelalter wurde vor allem in Thüringen der Anbau des Färberwaids
intensiv vorangetrieben – Erfurt kam durch den Handel mit
dem teuren Farbstoff zu so viel Reichtum, dass es aus den Erlösen
1392 seine Universität gründen konnte. Der Import aus Ostindien
ab dem 17. Jahrhundert zerstörte diesen Wirtschaftszweig –
die asiatische Indigopflanze zeichnet sich durch sehr viel höhere
Ausbeuten an Farbstoff aus.
1878 gelang dem deutschen Chemiker Adolf von Baeyer die erste künstliche
Herstellung von Indigo. In Reinform bildet die Verbindung dunkelblaue
Kristalle mit kupferrotem Glanz.
Indigo dient auch heute noch vor allem zum Färben von textilen Fasern
und sorgt für das so typische Jeansblau. Doch neben dem typischen
Blauton lassen sich durch chemische Modifikationen des Moleküls
auch andere intensive Farben hervorbringen, so z. B. das Indigo-Braun
oder Indigo-Rot.
Stephan T. Hatscher
Links zu dem Farbstoff Indigo:
http://www.seilnacht.tuttlingen.com/Lexikon/Indigo.htm
http://www.educeth.ch/chemie/labor/indigo/
http://www.dutly.ch/indigohtml/indigo1.html
Eine Biographie von Carl Engler, einem der beiden "Entwickler" (mit
Adolf von Baeyer) des synthetischen Indigos aus organischen Grundchemikalien,
findet sich unter:
http://www.ces.ka.bw.schule.de/zentral/ces_indigo.html
|
|
| |
|
|
| |
 1,2-Ethylenglykol
1,2-Ethylenglykol |
|
| |
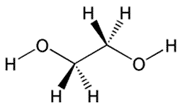
Um
nun in der kalten Jahreszeit zu verhindern, dass das Kühlwasser
der Autos einfriert, setzt man diesem so genannte Gefrier- oder
Frostschutzmittel zu. Dieser Zusatz sollte möglichst kostengünstig
und natürlich wasserlöslich sein und den Gefrierpunkt
des Wassers bei geringer Zugabe möglichst stark senken. Das
Kühlermetall darf jedoch nicht angegriffen werden und die Substanz
muss auch noch bei laufendem Motor stabil sein, weil sich das Kühlwasser
auf eine Temperatur um die 90 C erhitzen kann. Schwer entzündliche
organische Verbindungen wie die Glykole erfüllen diese Eigenschaften
und kommen als Frostschutzmittel daher vielfach zum Einsatz. 1,2-Ethandiol
ist ein Vertreter der Glykolfamilie und wird meist Ethylenglykol
genannt. Ein 1:1 Gemisch dieser Verbindung mit Wasser gefriert erst
bei -40 C.
Ethylenglykol ist eine farblose, süß schmeckende, zähe
Flüssigkeit, die in purer Form die Augen und die Atemwege reizt
und bei versehentlichem Verschlucken Herz und Nieren schädigen
kann. Auch wenn die im Handel erhältlichen Frostschutzmittel
nicht immer konzentriert sind, gehören sie aus diesem Grund
nicht in die Hände von Kindern und nur in die entsprechenden
Wasserbehälter des Autos.
Frostschutzbeschichtungen aus Ethylenglykol werden auf Flugzeugscheiben
aufgebracht, um dort die Eisbildung zu verhindern. Die Verbindung
findet außerdem Anwendung als Schmiermittel in Kühlanlagen
und ist in den Flüssigkeiten von hydraulischen Pumpen enthalten.
Weiterhin wird es im Textildruck, zur Großraumdesinfektion
und als Ausgangsprodukt für industrielle Produkte wie bestimmte
Polyesterarten, Wachse, Farbstoffe oder Lacke verwendet.
Deike
Banser
Mehr zum 1,2-Ethandiol und Frostschutzmitteln gibt es hier:
http://www.kopfball-online.de/filme/film_021124_a.html
http://www.seilnacht.tuttlingen.com/Chemie/ch_glyco.htm
http://www.chemieunterricht.de/dc2/facharbeit/12ethandiol.html
http://aktion-hummelschutz.de/fakten/hcerst3d.html
http://www.nobel.se/chemistry/laureates/2003/press-ge.html
|
|
| |
|
|
| |
 Nitroglycerin
Nitroglycerin |
|
| |
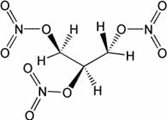

Fälschlicher
Weise wird die ölige, geruchlose Flüssigkeit Glycerintrinitrat
allgemein Nitroglycerin genannt.
Nach
Einatmen ihrer Dämpfe beschleunigt sich der Puls, Hitzewellen und
Kopfschmerzen stellen sich ein. In sehr kleinen Dosen wird Glycerintrinitrat
jedoch erfolgreich bei Asthma, Arterienverkalkung und bestimmten
Herzleiden verabreicht (vgl. Molekül der 18. Woche).
Bei
Erschütterung oder plötzlicher Erwärmung zerfällt die Verbindung
unter heftiger Explosion, was sie schon im 19. Jahrhundert zu einem
der wichtigsten Sprengstoffe im Bauwesen und Bergbau machte. Die
Handhabung des flüssigen „Sprengöls“ ist jedoch schwierig
und die Lagerung größerer Mengen der empfindlichen Substanz nicht
ungefährlich.
Der
schwedische Ingenieur Alfred Bernhard Nobel besaß eine Sprengmittelfabrik,
in der er nach Möglichkeiten suchte, die Nutzung der Sprengkraft
des Glycerintrinitrates einfacherer und sicherer zu machen. Letztendlich
verwandte er Kieselgur, welches feines Kieselgestein ist, um die
explosive Flüssigkeit wie in einen Schwamm aufzusaugen und entwickelte
damit das so genannte Dynamit, welches lange und vielfältig Verwendung
fand. Heute kommt Dynamit bzw. Glycerintrinitrat jedoch kaum noch
zum Einsatz.
Seiner
Zeit hat seine Entwicklung Alfred Nobel zu einem florierenden Geschäft
verholfen und ihn zu einem reichen Mann gemacht. Testamentarisch
verfügte er, dass die Zinsen seines beträchtlichen Vermögens alljährlich
an jene gehen sollte, die sich auf den Gebieten der Physik, Chemie,
Medizin, Literatur oder um die Erhaltung des Weltfriedens besonders
verdient gemacht haben. So wurde 1901 zum ersten Mal der so genannte
Nobelpreis verliehen. 1969 stiftete zudem die schwedische Nationalbank
einen Nobelpreis für Wirtschaftswissenschaften.
Traditionell werden
die Nobelpreise am 10. Dezember eines jeden Jahres in Oslo und
Stockholm an die Preisträger übergeben. Die US-Amerikaner Peter
Agre und Roderick MacKinnon erhalten dieses Jahr diese Auszeichnung
in Chemie für ihre Forschungsergebnisse auf dem Gebiet des Transportes
von Wasser und Ionen durch Zellmembranen.
 Deike
Banser Deike
Banser
Mehr zum Glycerintrinitrat
finden Sie unter:
http://www.gesundheit.de/roche/ro12500/r14102.html
http://dc2.uni-bielefeld.de/dc2/kampfst/explosiv.htm
Über
Alfred Nobel und den Nobelpreis können Sie sich hier informieren:
|
|
| |
|
|
| |
 Isooctan
Isooctan |
|
| |
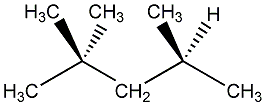
2,2,4-Trimethylpentan
ist der Name einer Verbindung, die umgangssprachlich Isooctan genannt
wird. Diese farblose und leicht entzündbare Flüssigkeit
dient unter anderem als Flugzeugkraftstoff und als Lösungsmittel
für Lacke. Auch bei der Herstellung von Paraffin (z.B. für
Kerzen) oder bestimmten Arten von Polyethylen wird es verwendet.
Im Alltag begegnen wir dem Isooctan bzw. einer seiner Eigenschaften
an der Tankstelle. Die nach dieser Substanz benannte Octanzahl für
Ottomotorenkraftstoffe ist nämlich auf jeder Benzinzapfsäule
zu finden. Die Octanzahl ist ein Maß für die so genannte
Klopffestigkeit des Benzins. Mit Klopfen ist die unregelmäßige
und daher schlecht zu kontrollierende Verbrennung im Motor gemeint,
die zu schweren Schäden führen kann. Daher werden möglichst
klopffeste Benzinarten, das heißt solche mit einer hohen Octanzahl
verwendet. Die Maßzahl wurde nach diesem Molekül der
Woche benannt, da es eine besonders klopffeste Verbindung ist und
man aufgrund dessen ihre Octanzahl willkürlich auf 100 gesetzt
hat. Die Octanzahl 0 wurde dem sehr klopffreudigen n-Heptan zugeordnet.
So können die Klopfeigenschaften aller Kraftstoffe mit denen
dieser beiden Verbindungen verglichen und deren Octanzahl ermittelt
werden. Die Klopffestigkeit nimmt vom normalen Benzin über
Super bis hin zur Super Plus-Qualität hin zu und damit auch
deren Octanzahlen.
Für Dieselkraftstoffe verwendet man im Übrigen die so
genannte Cetan-Zahl als Maß für die Klopffestigkeit.
Deike
Banser
Mehr
Informationen zum Isooctan finden Sie unter:
http://enius.de/schadstoffe/isooctan.html
http://www.unibw-muenchen.de/campus/MB/we6/zeman/kraftstoffe/zeman_kraftstoffe_4.htm
http://www.aral-forschung.de/forschung/glossar/03.content.html
|
|
| |
 Cyclooctaschwefel
Cyclooctaschwefel |
|
| |
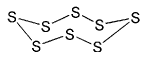
Schwefel
ist eins der über hundert chemischen Elemente, das heißt er besteht
praktisch nur aus einer Atomsorte, die in der chemischen Kurzschreibweise
mit S dargestellt werden. Diese Schwefelatome fügen sich zu einer
Fülle von verschiedenen Molekülen zusammen. Der oben dargestellte
Achtring ist unter anderen Ringen und kettenförmigen Molekülen
die am häufigsten auftretende Form. Sie bildet bei Raumtemperatur
Pulver oder Brocken von hell gelber Farbe.
Schwefel
wird industriell hauptsächlich zur Schwefelsäureherstellung verwendet,
einer der wichtigsten Industriechemikalien. Auch die Gummi- und
Aluminiumindustrie benötigen große Mengen des Elementes. Nach dem
Verbrennen dient Schwefel zum Bleichen von Waren aus Wolle, Seide,
Gelantine oder Stroh. Fässer oder Konservengläser werden zur Desinfektion
„ausgeschwefelt“ und zahlreiche Hautkrankheiten können
mit schwefelhaltigen Salben behandelt werden. In der Landwirtschaft
wird er zur Bekämpfung von echtem Mehltau oder Spinnmilben eingesetzt.
Schwefel
ist zudem brennbar und verbrennt mit blauer kaum leuchtender Flamme.
Diese Eigenschaft begründet seinen Einsatz in der Pyrotechnik beispielsweise
im Schwarzpulver oder in Feuerwerken. Letztere, wie das Bengalische
Feuer, bestehen aus Gemischen eines so genannten Oxidationsmittels
mit einem Brennstoff, häufig Holzkohle oder Schwefel, und dem Mittel
zur Flammenfärbung. Diese unter Umständen mit einem Bindemittel
verarbeitet werden. Der Brennstoff und das Oxidationsmittel reagieren
nach der Zündung heftig unter Feuererscheinung miteinander. In den
heißen Flammen werden die Zusätze für die Flammenfärbung zum leuchten
angeregt. Je nach nach Verbindung senden sie unterschiedlich farbiges
Licht aus. Man erhält beispielsweise bei Verwendung von Lithium-
oder Strontiumverbindungen rotes Feuerwerk, Borsäure oder Bariumsalze
sorgen für grüne Flammen, spezielle kupferhaltige Verbindungen bringen
blaues Leuchten an den Himmel und Cäsium- oder Kaliumsalze ein violettes.
Leider
geht mit dem herrlichen Schauspiel am Himmel und der Knallerei an
Silvester auch eine erhebliche Belastung der Luft und Verschmutzung
der Straßen mit Müll einher. Verbrennt nämlich Schwefel, so verbindet
er sich mit Sauerstoff zu Schwefeldioxid, einem Gas, das höchst
ungesund ist, und unter anderem für das Phänomen des sauren Regens
verantwortlich ist.
Deike
Banser
Mehr
zum Schwefel, Schwarzpulver und Feuerwerk finden Sie hier:
|
|
| |
|
|
|
|