| |
| |
|
|
| |
|
|
| |
|
|
| |
 Ozon
Ozon |
|
| |

Ozon
ist ein äußerst giftiges, farbloses Gas. Der Name des stechend
riechenden Gases stammt aus dem Griechischen (ozein = „nach
etwas riechen“).
Gerade
bei großer Hitze im Sommer entstehen durch Smog und Abgase erhöhte
Ozonwerte, die dann zu Atembeschwerden und verminderter Leistungsfähigkeit
führen. Auch in Höhensonnen, in Fotokopierern in der Nähe von Hochspannungsleitungen
oder beim Schweißen kann Ozon entstehen.
In
den unteren Schichten unserer Atmosphäre ist Ozon also nicht gern
gesehen, es sei denn, es wird gezielt für die Desinfektion von Trinkwasser
oder Schwimmbädern, zum Bleichen von Wachsen, Textilfasern oder
Papier oder zur Behandlung von Kunststoffen eingesetzt. Da es sehr
reaktiv ist, wird es recht zügig wieder abgebaut und verbleibt nach
entfernen der Entstehungsquelle nicht lange in der Luft.
In
30 km Höhe spricht kein Mensch mehr von Luftverunreinigung im Zusammenhang
mit Ozon. Die energiereiche Strahlung der Sonne im ultravioletten
(UV) Bereich ermöglicht hier ein Gleichgewicht zwischen dem Auf-
und Abbau des reaktiven Ozons, was verhindert, dass diese besonders
hautaktive Strahlung die Erdoberfläche in hoher Konzentration erreicht.
So wird das Leben auf der Erde vor zu hoher UV-Strahlung geschützt.
Es gibt Substanzen, die ohne die Mitwirkung von Sonnenlicht dafür
sorgen, dass Ozon abgebaut wird. Nimmt deren Konzentration zu stark
zu, wird zu viel Ozon durch Reaktion mit diesen Stoffen abgebaut
und es kann weniger energiereiches Sonnenlicht absorbiert werden.
Daher wurden beispielsweise Fluorchlorkohlenwasserstoffe (FCKWs)
weitestgehend aus dem alltäglichen Leben, vor allem aus Kühlschränken
und Sprühdosen verbannt, da diese in der Stratosphäre den Ozonzyklus
nachhaltig stören.
Deike
Banser
Mehr
über den „Sonnenschirm unseres Planeten“ finden sie
auf:
|
|
| |
|
|
| |
 Wasserstoff
Wasserstoff |
|
| |
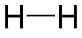
Wasserstoff
ist das leichteste aller chemischen Elemente. Unter Normalbedingungen
besteht Wasserstoff aus zweiatomigen Molekülen, die ein geruch-
und farbloses, brennbares und ungiftiges Gas bilden, das leichter
als Luft ist, und daher für den Auftrieb von Luftschiffen verwendet
wird.
Der
englische Chemiker Henry Cavendish entdeckte den Wasserstoff 1766
und fand später heraus, dass bei seiner Verbrennung Wasser
als Produkt entsteht, woraus sich der Name des Gases ableitet. Da
bei der Verbrennung von Wasserstoff neben dem Wasser sehr viel Energie
freigesetzt wird, ist Wasserstoff zur Energiebereitstellung als
Betriebstoff für Brennstoffzellen in Diskussion. In einer Wasserstoffbrennstoffzelle
wird die Energie der Verbrennung direkt in elektrische Energie umgewandelt,
die beispielsweise für den Antrieb eines Motors genutzt werden
kann. Leider sind die benötigten Brennstoffzellen noch sehr
schwer und die Wasserstoffgewinnung sehr teuer und häufig mit
einem erheblichen Aufwand an Energie und unter Emission des Treibhausgases
Kohlenstoffdioxid verbunden. Auch muss noch die Hürde der sicheren
und großräumigen Versorgung mit dem leicht brennbaren
und flüchtigen Gas genommen werden. In vielen anderen Zweigen
der Industrie wird elementarer Wasserstoff schon lange vielseitig
eingesetzt, so zur Synthese von Ammoniak oder Methanol, zur Fetthärtung
oder zur Gewinnung von Metallen wie Wolfram oder Cobalt und zu deren
Verarbeitung durch autogenes Schweißen. Im interstellaren
Raum ist Wasserstoff das am häufigsten vertretene Element und
auch die Sonne besteht zu über 80 % aus diesen Atomen, deren
Kernreaktionen hauptsächlich für die Erzeugung ihrer Energie
verantwortlich sind. Auf unserem Planeten kommt Wasserstoff überwiegend
in Verbindungen mit anderen chemischen Elementen vor, besonders
als Wasser aber auch an Kohlenstoff gebunden in fast allen organischen
Verbindungen.
Deike Banser
Mehr über Wasserstoff
finden Sie unter:
http://www.seilnacht.tuttlingen.com/Lexikon/1Wassers.htm
http://www.hydrogen.org/indexd.html
http://www.uniterra.de/rutherford/ele001.htm
|
|
| |
|
|
| |
 Stickstoff
Stickstoff |
|
| |
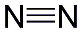
Carl
Scheele nannte 1772 das Gas mit der chem. Formel N2 „verdorbene
Luft“, da es weder die Verbrennung unterhält noch die Atmung
unterstützt, obwohl es mit 78% Hauptbestandteil der Luft ist. Stickstoff
dient u.a. als Kühlmittel, da dessen Verflüssigung relativ einfach
ist. Man erhält dabei eine Flüssigkeit mit einer Temperatur um –195
°C. Damit werden z.B. frische Kräuter eingefroren und zerschlagen,
um sie als tiefgekühlte Streukräuter in den Handel zu bringen.
Verbindungen des Stickstoffs sind als Dünger wichtig. Das Verfahren,
bei dem der sehr reaktionsträge Stickstoff in der Düngemittelproduktion
genutzt werden kann, heißt nach seinen Entdecker Haber Bosch ;Verfahren
und ist auch noch nach 90 Jahren einer der größten Zweige der chem.
Industrie.
Stephan
T. Hatscher
Ausführlichere Informationen zum Stickstoff erhalten Sie unter:
http://www.seilnacht.tuttlingen.com/Lexikon/7Stickst.htm
http://dc2.uni-bielefeld.de/dc2/wsu-teok/kap_053.htm
http://dc2.uni-bielefeld.de/dc2/katalyse/k-nh3.htm
zur
biochemischen Umsetzung des Stickstoffs:
http://www.biologie.uni-hamburg.de/b-online/d34/34b.htm
|
|
| |
|
|
| |
 Sauerstoff
Sauerstoff |
|
| |
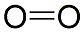
In
den siebziger Jahren des 18. Jahrhunderts erhielt Carl Wilhelm Scheele
im Verlauf seiner Experimente ein höchst reaktionsfreudiges Gas,
welches er Feuerluft nannte, da es mit vielen Stoffen unter Feuererscheinung
reagiert. Antoine Lavosier nahm an, dass die Feuerluft in allen
Säuren enthalten sei und soll den Namen Oxygenium (Säurebildner)
geprägt haben, wovon sich das Kürzel - O - für das Element und sich
der deutsche Name Sauerstoff ableiten. Die chemische Formel des
Gases ist O2, denn es besteht aus zwei Sauerstoffatomen.
Die Erdatmosphäre besteht durchschnittlich zu ca. 21 % aus Sauerstoff,
wovon sich ein Teil in den Oberflächengewässern löst. So steht diese
Verbindung praktisch allen Organismen für die lebenswichtige Atmung
zur Verfügung. Auch bei Fäulnisprozessen, beim Rosten oder Bränden,
so auch in einer Kerzenflamme, wird Sauerstoff verbraucht. Der empfindliche
Sauerstoffkreislauf wird durch die Sauerstoffproduktion bei der
Photosynthese durch Pflanzen und Grünalgen geschlossen. Sauerstoff
ist das häufigste Element unseres Planeten und taucht auf diesem
in mannigfaltigen Verbindungen auf.
Eine der vielleicht wichtigsten ist das Wasser, aber auch fast alle
Gesteinsarten sind Sauerstoffverbindungen. Reiner Sauerstoff wird
statt Luft für industrielle Prozesse verwendet, wenn Reaktionen
dieses Stoffs intensiviert werden sollen. So findet das Gas beispielsweise
bei vielen Metallgewinnungen und –verarbeitungen wie dem autogenen
Schweißen Anwendung. Es ist Ausgangssubstanz bei der wichtigen Schwefelsäureherstellung
und kommt für Sprengzwecke und Raketenantriebe zum Einsatz. Auch
in der Medizin, zum Bleichen oder in Brennstoffzellen wird Sauerstoff
verwendet.
Deike
Banser
Mehr über Sauerstoff erfahren sie unter:
http://www.seilnacht.tuttlingen.com/Lexikon/6Sauerst.htm
http://www.uniterra.de/rutherford/ele008.htm
http://www.airliquide.de/loesungen/produkte/gase/gasekatalog/stoffe/katalog/sauerstoff.html
|
|
| |
|
|
| |
 Stickstoffmonoxid
Stickstoffmonoxid |
|
| |
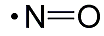
Stickstoffmonoxid
ist ein kleines Molekül, das aus nur zwei Atomen der Elemente Stickstoff
und Sauerstoff aufgebaut ist. Blitze oder Verbrennungen in Motoren
können genug Hitze liefern, um die Bildung dieser Verbindung aus
dem Stickstoff und dem Sauerstoff der Luft zu ermöglichen. Sie kommt
als Zwischenprodukt in technischen Verfahren wie der Herstellung
von Salpetersäure vor, die beispielsweise bei der Produktion von
Düngemitteln zum Einsatz kommt.
Obwohl es sich beim Stickstoffmonoxid um ein farbloses und giftiges
Gas handelt, wird die Verbindung auch im menschlichen Körper gebildet
und erfüllt hier vielfältige Aufgaben. Im Gehirn fungiert das Molekül
als Botenstoff bei bestimmten nervlichen Prozessen. Es beeinflusst
das Lernen, das Gedächtnis, Schlaf- und Wachzustände, die Steuerung
des Hungergefühls sowie das Geruchsempfinden. Es wirkt entspannend
auf die Blutgefäße und reguliert somit den Blutfluss, den Blutdruck
und hemmt die Gerinnung. Dadurch ist es ein wichtiger Faktor für
die Vermeidung von Thrombosen.
Im Körper wird diese Substanz auch aus Nitroglycerin freigesetzt,
weshalb man letzteres zur Behandlung von krankhaften Gefäßverengungen
wie Arterienverkalkung einsetzen kann. Die entscheidende Rolle des
Stickstoffmonoxids im Organismus konnte erst vor wenigen Jahren
aufgedeckt werden. Daher ist das Molekül immer noch ein Thema in
der aktuellen Forschung.
Deike Banser
Weitere Informationen zum Stickstoffmonoxid finden Sie unter:
http://www.swisseduc.ch/chemie/schwerpunkte/no/
http://www.medizin-netz.de/framesets/fsetscienceno.htm
http://dc2.uni-bielefeld.de/dc2/auto/nox.htm
|
|
| |
|
|
| |
 Chrysanthemin
Chrysanthemin |
|
| |
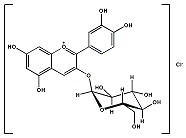
Chrysanthemin
ist eine Verbindung, die rotbraune dünne Kristalle
bildet. Eine weitere Bezeichnung
für das Molekül ist Asterin, entsprechend ihres Vorkommens in Astern
und Chrysanthemen, also auch in vielen Früchten wie Holunderbeeren,
Brombeeren, Heidelbeeren, Blutorangen oder Pfirsichen, bei denen
es für appetitliche Färbungen
sorgt.
Es gehört zu
der Familie der so genannten Anthocyane, einer Gruppe von Pflanzenfarbstoffen,
die für Lebensmittel verwendet und unter der Inhaltstoffliste mit
E 163 gekennzeichnet werden. Der Familienname stammt von den griechischen
Begriffen für Blüte (anthos) und blau (kyanos). Cyanin, Malvin und
Pelargonin sind ebenfalls Vertreter dieser Verbindungsgruppe, die
je nach Zusammensetzung des Zellsaftes der Pflanzen blaue bis violette
Farbtöne annehmen.
Deike
Banser
Mehr finden Sie zum
Chrysanthemin unter
http://www.gym1.at/chemie/matura/lebensm/farbstof/farb_1.htm
http://www.rosengarten-dresden.de/site/rosen/fs_ros.html
http://www.rosengarten-dresden.de/site/rosen/doc_sortenliste_ddr_farbe3.html
http://www-ang.kfunigraz.ac.at/~katzer/germ/generic_frame.html?Rhus_cor.html
|
|
| |
|
|
| |
 Poly-N-Acetylglycosamin
(Chitin)
Poly-N-Acetylglycosamin
(Chitin) |
|
| |
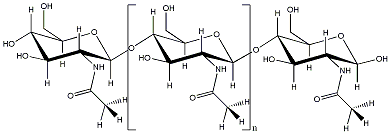
Das
Molekül dieser Woche ist wieder ein Polymer: Aus etwa 2.000 Zuckereinheiten
ist dieses Polysacharid aufgebaut – und ist der zweithäufigste
Zucker weltweit.
Sein Name kommt aus dem Griechischen und bedeutet "Panzer", in Anlehnung
daran, dass aus Chitin die "Rüstungen" also die Außenskelette der
Insekten, Krebse und Spinnen aufgebaut sind. Hier beweist es außergewöhnliche
Flexibilität bei hoher Reiß- und Biegestabilität in vielerlei Formen
und für die unterschiedlichsten Verwendungszwecke. Es findet sich
auch in bestimmten Algen, Hefen, Pilzen und Flechten.
Doch neben dieser "Anwendung" im Tierreich wird Chitin auch vom
Menschen künstlich hergestellt und verwendet. Fasern dienen als
abbaubare Wundverbände. Chitinderivate werden als Klebstoffe, Bindemittel
und Membranen erfolgreich eingesetzt. Chitin löst sich nicht in
Wasser oder organischen Lösungsmitteln. Schnecken oder bestimmte
Bakterien oder Schimmelpilze jedoch verfügen über Enzyme, die das
Material "knacken" können – und nach seiner Spaltung in die
Einzelbausteine ist Chitin letztendlich doch nur Zucker.
Stephan T. Hatscher
Links zum Thema Chitin:
http://insel.heim.at/malediven/350824/krabben-NEU/Dateien/chitin.html
http://www.hitechnatur.ch/bauen/5/chitin.html
http://www.chemryb.at/schuelerproj/sp_chitin/sp_chitin_start.htm
|
|
| |
|
|
| |
 Chlorophyll
Chlorophyll |
|
| |
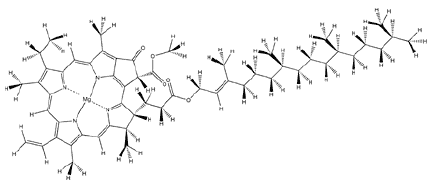
„Ach
ist das schön! Ach ist der Rasen schön grün!“,
rief schon Wilhelm Bendow aus. Die Ursache seiner Begeisterung kann
man praktisch an einer einzigen Substanz fest machen – nämlich
am Chlorophyll. Es sorgt für das Grün aller höheren
Pflanzen, Grünalgen und sogar einiger Bakterien und befähigt
diese Photosynthese zu betreiben. Als Photosynthese oder auch Assimilation
bezeichnet man die Bildung von Kohlenhydraten – also von Zuckern
und Stärke – aus Wasser und dem Kohlenstoffdioxid der
Luft mit Hilfe von Sonnenlicht.
Der Name dieser Verbindungsfamilie, die gut ein halbes Dutzend Mitglieder
hat, ist dem Griechischen entlehnt (chloros = gelbgrün und
phyllon = Blatt). Oben dargestellt ist das Chlorophyll a, welches
am häufigsten vorkommt.
Richard Willstätter trug maßgeblich zur Aufklärung
der Struktur von Chlorophyll bei und erhielt dafür und seine
Untersuchungen anderer Pflanzenfarbstoffe 1915 den Nobelpreis.
Im Herbst wird in vielen Pflanzen das Chlorophyll abgebaut, so dass
die Färbung der Blätter von anderen Blattfarbstoffen bestimmt
wird. So verursachen beispielsweise die Vertreter der Carotinoidfamilie
die freundlichen altweibersommerlichen Rot- und Gelbtöne vieler
Laubbäume.
Da Chlorophylle im Allgemeinen ungiftig sind finden sie in Lebensmitteln,
Kosmetika und in Kerzen als Farbstoffe Verwendung.
Deike Banser
Mehr zum Blattfarbstoff
Chlorophyll können Sie hier nachlesen:
http://www.zzzebra.de/index.asp?themaid=587
http://www.defined.de/chloroplasten/cphyll.htm
http://www.ethz.ch/overview/nobelprize/people/r-willstaetter-de.html
|
|
| |
|
|
| |
 Cellulose
Cellulose |
|
| |
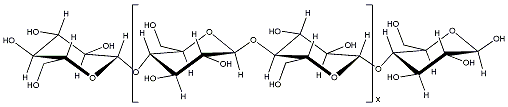
1837
gelang es dem französischen Landwirt A. Payen aus Pflanzenzellen
eine Substanz zu isolieren, die er nach dem lateinischen Wort cellula
(dt: kleine Zelle) benannte. Mit der Entdeckung der Cellulose fand
er die in der belebten Natur häufigste Verbindung, da sie das Hauptmaterial
für die Wände praktisch aller Pflanzenzellen ist. Cellulosemoleküle
sind lange gerade Ketten, die aus so genannten Cellubiose-Einheiten
aufgebaut sind. Ein Cellubiosebaustein besteht aus zwei einfachen
Zuckermolekülen. Obwohl die Ketten sehr lang sein können, mit bis
zu 5.000 Cellubiosebausteinen, sind Cellulosemoleküle sehr stabil
und verleihen den Pflanzen dadurch ihre Stabilität. Ein Baum bildet
pro Tag etwa 14 g Cellulose.
Technische Celluloseprodukte bezeichnet man allgemein als Zellstoff,
zu denen Filterpapiere, Watte oder Papier gehören. Für die Herstellung
dieser Produkte kommen hauptsächlich Holz, Schilf, Stroh oder Mais-
und Sonnenblume nstengel als Celluloselieferanten zum Einsatz. Auch
Textilfasern, wie Baumwolle, Kunstseide, Flachs oder Hanf sind cellulosereiche
Fasern. Die weitaus größten Cellulosemengen werden in der Textil-
und Papierindustrie verbraucht, aber auch viele andere Zweige verwenden
diese Substanz als Binde- oder Füllmittel in Lacken, Zahnpasten,
Cremes, Tabletten oder Zigaretten.
Deike Banser
Mehr zur Cellulose finden Sie hier:
http://www.foodnews.ch/x-plainmefood/lebensmittel/Cellulose.html
http://www.sonnenseite.oekoserve.net/fp/archiv/RUBwerkstoff-material-substanz/Cellulose.php
http://www.biologie.uni-hamburg.de/b-online/d26/26a.htm
|
|
| |
|
|
|
|