| |
| |
|
|
| |
Bengalisches Feuer - Flammenfärbung |
|
|
|
|
| |
Versuch
Nr.048
Bewertung / Schwierigkeitsgrad:   
Zeitaufwand: 15 min Vorbereitung, 5 min Vorführung |
|
|

|
| |
|
|
| |
Ziel:
Einige Stoffe rufen in der heißen Brennerflamme
charakteristische Färbungen hervor. Sie werden durch die Elemente
verursacht, die in diesen Verbindungen enthalten sind. So verraten
sich schon Spuren von Natriumsalzen durch intensive gelbe Flammenfärbung.
In der analytischen Chemie wird der Effekt als empfindliches Nachweisverfahren
für bestimmte Metalle benutzt. Man nutzt den Effekt der Flammenfärbung
auch in der Pyrotechnik z. B. in Feuerwerksraketen und bengalischen
Feuern. Im Experiment wird die Herstellung eines intensiv rot leuchtenden
Bengalischen Feuers beschrieben.
|
|
| |
Geräte:
2 kleine Bechergläser, Schutzbrille, Salpeterpapier
(oder ähnliche Zündschnur bzw. Wunderkerze), feuerfester
Untergrund (Asbestplatte, Porzellanscherbe),
Spatel
|
|
| |
Chemikalien:
Kaliumchlorat, Strontiumnitrat, Saccharose
|
|
| |
Sicherheitshinweise:
 Achtung:
Die
Stoffe dürfen niemals zusammen in einer Reibschale gemischt
oder zerkleinert werden. Explosionsgefahr!
Achtung:
Die
Stoffe dürfen niemals zusammen in einer Reibschale gemischt
oder zerkleinert werden. Explosionsgefahr!
Strontiumnitrat (Sr(NO3)2):
O R8
Kaliumchlorat (KClO3): O,Xn
R9-20/22 S13-16-27
Saccharose (C12H22O11):
keine besonderen Sicherheitshinweise
 O O
 Xn Xn
 E E
 Achtung:
Immer wieder kommt es während Fußballspielen dazu,
dass in den Zuschauerbereichen Bengalische Feuer abgebrannt werden.
Den Fans, die dadurch offensichtlich ihrer Begeisterung Ausdruck
verleihen wollen, dürfte häufig nicht bewusst sein, welche
Gefahren dadurch entstehen:
Achtung:
Immer wieder kommt es während Fußballspielen dazu,
dass in den Zuschauerbereichen Bengalische Feuer abgebrannt werden.
Den Fans, die dadurch offensichtlich ihrer Begeisterung Ausdruck
verleihen wollen, dürfte häufig nicht bewusst sein, welche
Gefahren dadurch entstehen:
Das
"Bengalfeuer" oder die "Seenot-Rettungsfackel"
entwickelt eine Abbrenntemperatur von 1.600 bis 2.500°C. Verbrennungen
können selbst dann hervorgerufen werden, wenn ein direkter
Kontakt mit dem Feuer gar nicht zustande kommt. Ein Löschen
dieser pyrotechnischen Feuer ist während der Abbrenndauer nicht
möglich! Die Reste des ausgebrannten Behälters sind noch
über lange Zeit so heiß, dass sie auch bei kurzer Berührung
zu erheblichen Verbrennungen führen können.
Deshalb
gilt: Wer entgegen der Stadionverordnung Pyrotechnik mitführt
oder verwendet, begeht eine Ordnungswidrigkeit. Das von der Landeshauptstadt
München festgesetzte Bußgeld beträgt z.B. in der
Regel bei Ersttätern zwischen 100,-- und 150,-- Euro. Wer innerhalb
der Zuschauerbereiche Pyrotechnik abbrennt, muss unter Umständen
sogar mit einer Strafanzeige wegen eines Vergehens der (versuchten)
gefährlichen Körperverletzung rechnen. Wer andere beim
Abbrennen der Pyrotechnik unterstützt, kann sich ebenfalls
strafbar machen.
(Quelle: http://www.polizei.bayern.de/ppmuc/schutz/text8.htm)
|
|
| |
Einverständniserklärung:
Hiermit erklären Sie sich bereit den folgenden Versuch unter
eigener Verantwortung
und nur mit ausreichendem chemischen Wissen und geeigneten Schutzvorrichtungen
durchzuführen!
Der Autor kann für jegliche Personen- und Sachschäden
durch mögliche Fehlversuche nicht haftbar gemacht werden. (siehe
Sicherheitscheck bzw. Disclaimer) |
|
| |
|
|
| |
Versuchsanleitung: 
Für rotes Bengalfeuer stellt man folgende Mischung
zusammen:
3
Teile Kaliumchlorat (z.B. 6g)
1-1,5 Teile Saccharose (2-3g)
0,1-0,5 Teile Strontiumnitrat
(0,2-1g)
evtl. eine Spatelspitze rotes Eisenoxid (Katalysator)
Die
Mischung wird vorsichtig (!) auf einem glatten Papier miteinander
vermischt. Auf keinen Fall in einer Reibschale mit Druck verreiben
(Explosionsgefahr)! Am besten man hebt die Pulver vorsichtig gegenseitig
unter. Anschließend wird das Gemisch kegelförmig auf
einer feuerfesten Unterlage aufgeschüttet und mit einer mindestens
10 Zentimeter langen Zündschnur bestückt. Nach dem Zünden
sollte ein angemessener Sicherheitsabstand eingenommen werden. (Alternativ
kann das Gemisch mit einer langen Wunderkerze gezündet werden,
jedoch nie mit einem Bunsenbrenner --> Explosionsgefahr!)
Mischt
man an Stelle von Strontiumnitrat Bariumnitrat unter das Gemenge,
so zeigt die Flamme eine fahlgrüne Färbung.
 Flammenfärbung
verschiedener Metalle:
Flammenfärbung
verschiedener Metalle: |
|
|
| |
Kupferacetat |
Kaliumiodid |
Magnesium |
|
|
| |
Eisen |
Strontiumnitrat |
Natriumchlorid |
|
|
|
| |
Entsorgung:
(siehe auch Entsorgungsmaßnahmen)
Die Verbrennungsrückstände werden in Wasser
gegeben und mit Natriumcarbonat versetzt. Die abgetrennten unlöslichen
Bestandteile werden bei den Schwermetallabfällen entsorgt.
Flüssigkeitsreste können im Abluss entsorgt werden.
|
|
| |
Erklärung
/ Hintergrund:
Chlorate und Nitrate wirken als starke Oxidationsmittel,
die die Saccharose
(Reduktionsmittel) in die jeweiligen Oxide überführen.
Dabei werden sie selbst zu Chloriden und Nitriten reduziert. Durch
die hohen Temperaturen dieser stark
exothermen Reaktion emittieren Strontiumsalze ein karminrotes Licht.
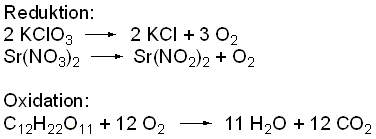
Das
farbige aufleuchten der Flamme entsteht durch Vorgänge in der
Elektronenhülle der Atome. Bei hohen Temperaturen kommt es
zur Anregung von Außenelektronen, den sogenannten Leuchtelektronen
die unter Aufnahme von Energie ein höheres Energieniveau besetzen.
Bei ihrer Rückkehr auf das Niveau des Grundzustandes wird die
dabei wieder freigesetzte Energie in Form von Licht abgestrahlt.
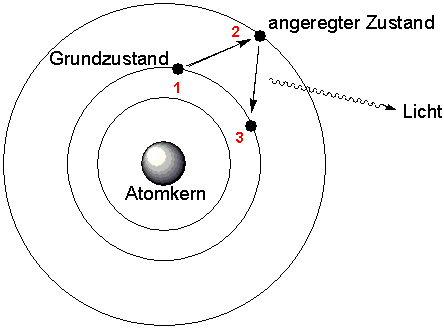
Schritt
1: Elektronen
nehmen Energie auf
Schritt 2: Anhebung auf ein höheres
Besetzungsniveau
Schritt 3: Rückkehr zum Grundzustand
unter Aussendung von Licht
|
|
| |
Links:
Atommodelle:
Viele Informationen über die Atommodelle von Rutherford und
Bohr und denAufbau der Atome nach dem Schalen- und Orbitalmodell.
Linienspektren,
der Schlüssel zum Verständnis der Struktur der Atomhülle:
Infos über die von Robert Bunsen entwickelte Spektralanalyse
sowie...
Bohrs
allgemeine Formel für empirischen berechneten Linien der Balmerserie
des Wasserstoff-spektrums
Metalle:
Klassifikation, Bindungen, Gitterstrukturen Vom Elektronengasmodell
über das Energiebändermodell und die Kristallstrukturen
findet man hier alles den Aufbau von Metallen.
Allgemeine
Metallinfos: Leitfähigkeit, Vorkommen, Gewinnung, Physikalische
Eigenschaften,Verwendung, Dichteverlauf, Ionenradien, Magnetismus,
Oxidationsstufen, Kationenbildung, Flammenfärbungen, Häufigkeit
der Elemente
Quellenangabe:
[1] By de:Freedom_Wizard (Own work) [GFDL (www.gnu.org/copyleft/fdl.html) or CC-BY-3.0 (www.creativecommons.org/licenses/by/3.0)], via Wikimedia Commons
|
|
|
|